トップページ > 健康・福祉 > 医療 > 薬事 > 申請・手続き > 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(旧薬事法) > 医薬品・医薬部外品・化粧品の製造販売業及び製造業の方へ
ページ番号:19131
掲載日:2025年3月28日
ここから本文です。
医薬品・医薬部外品・化粧品の製造販売業及び製造業の方へ
医薬品・医薬部外品・化粧品の製造販売業者・製造業者の方を対象としたページです。
初めて製造販売業及び製造業の許可の取得をお考えの方は、必ず、事前に相談してください。また、 「初めて医薬品・医薬部外品・化粧品を製造販売、製造、輸入される方へ」を参照してください。
- 申請等の案内
- 医薬品等適合性調査について
- 申請手数料一覧(※手数料の納付方法含む)
- 自主回収について
- 医薬品等の表示・広告の相談を希望される方へ
- 緊急情報提供及び収集体制の整備について
- 申請等のオンライン提出について
1.申請等の案内
(1)申請・相談等の受付について
申請書・届出等の提出及び相談は、電話による予約制です。
予約は先着順ですので、早めの日程調整に御協力をお願いします。
- ア電話による予約受付時間
午後1時~午後2時(月曜~金曜※県の休日を除く)
電話048-830-3627 - イ申請・相談等の受付時間
- 申請・届出等午前9時~正午(15分~30分毎)
- 相談、GMP関係書類審査等午後2時~4時30分(30分毎)
(2)製造販売業及び製造業の許可申請の流れ
【事前相談】*新規、製造所の移転の場合
- 製造販売業:GQP、GVP、総括製造販売責任者などについて
- 製造業:構造設備、製造管理者・責任技術者などについて
⇓
【業者コード登録】
業者コードは、医薬品、医薬部外品、化粧品の業許可申請等を行う際に必要になります。
業許可申請等を行う前に、e-Gov電子申請サービス(やむをえない場合はファクシミリ)で厚生労働省へ業者コード登録を申請してください。
e-Govを利用した業者コード登録マニュアル(厚生労働省医薬品審査管理課)(PDF:766KB)(別ウィンドウで開きます)
(様式)
様式1業者コード登録票(ワード:19KB)(別ウィンドウで開きます)
様式2業者コード変更登録票(ワード:18KB)(別ウィンドウで開きます)
- ファクシミリによる申請
電子申請が行えない場合は、申請様式に必要事項を入力し、以下のファックス番号までファクシミリでご申請ください。
厚生労働省医薬局医薬品審査管理課:03-3597-9535
⇓
【申請書提出】電子申請ソフト(FD申請ソフト)(外部ページへリンクします)にて作成。
FD申請ソフトでの作成方法については、作成方法(PDF:541KB)を参考にしてください。また、外部媒体に出力する方法については、出力方法(PDF:751KB)を確認してください。
医薬品等製造販売業・製造業許可申請に必要な書類を揃え、申請書に添付してください。
⇓
【実地調査】(必要に応じて改善指示・改善報告)
⇓
【許可】※許可調査実施要領に基づく
(3)許可後の手続について
許可の有効期間は、製造販売業、製造業のいずれも5年間です。
許可を継続する場合には、更新の手続が必要となります。新規申請時と同様に電子申請ソフト(FD申請ソフト)(外部ページへリンクします)にて更新申請書を作成の上、有効期間満了日のおおむね3か月前に提出してください。
また、許可後に医薬品医療機器等法施行規則で定められた事項の変更があった場合には、変更後30日以内に届出が必要となります。詳しくは変更届についてのページにて御確認ください。
(4)製造販売業及び製造業許可調査要領
埼玉県内の製造販売業者、製造業者の許可調査は、以下の要領に基づいて行います。
|
様式4 |
|
|
様式5 |
|
|
様式9 |
|
|
様式10 |
|
様式5 |
|
|
様式6 |
|
|
様式11 |
|
|
様式12 |
2.医薬品等適合性調査について
(1)適合性調査の実施方法について
医薬品等適合性調査申請書の提出
- 申請に関する相談は、お早めにお願いします。
- 適合性調査申請は、調査結果希望日の約3か月前に薬務課に来課して行ってください。
- 申請日はあらかじめ薬務課医薬品化粧品生産指導担当(電話:048-830-3627)に電話して予約をとってください。
- 申請手数料については、3.申請手数料一覧をご覧ください。
⇓
事前資料の提出
調査対象者は、調査の3週間前までに事前資料を提出してください。
⇓
(調査方法の決定(実地調査or書面調査)、日程調整、調査計画)
⇓
(薬務課から調査対象者あてGMP調査通知書の送付)
⇓
調査実施
- 調査により指摘事項があった場合には、調査対象者に対してGMP調査指摘事項書を交付します。
- 指摘事項書が交付された調査対象者は、改善結果報告書又は改善計画書を提出してください。
⇓
(薬務課にて調査結果を審査)
⇓
(適合性調査結果をシステムにて承認権者あて通知)
(適合性調査結果通知書の写しを申請者に対して交付)
(実地調査を行なった場合は、GMP調査結果報告書の写しを調査対象者に対して交付)
(2)医療用後発医薬品に係るGMP適合性調査申請について
医療用後発医薬品に係る承認審査及びGMP適合性調査等のスケジュール(PDF:55KB)をご確認ください。
(3)GMP適合性申請に必要な書類及び事前提出資料
- GMP適合性調査申請(承認申請時、一変申請時)(PDF:76KB)
- GMP適合性調査申請(変更計画時)(PDF:77KB)
- GMP適合性調査申請(定期調査)(PDF:79KB)
- 輸出用GMP適合性調査申請(製造開始時)(PDF:74KB)
- 輸出用GMP適合性調査申請(定期調査)(PDF:78KB)
- GMP区分適合性調査申請(PDF:82KB)
≪様式≫
- バリデーション一覧表(エクセル:38KB)
- 承認後の経過に関する資料(PDF:59KB)
- 宣誓書(PDF:5KB)
- 代表品目に関する資料(ワード:22KB)
- 製造工程の区分で製造する品目のリスト
- 製造品目リストの査察履歴
- GMP調査事前報告書 様式F02(ワード:67KB)
- GMP調査指摘事項改善計画/改善結果報告書 様式F06(ワード:19KB)
3.申請手数料一覧
申請書等の窓口申請・オンライン提出時の申請手数料の納付方法は、
「窓口でのキャッシュレス納付」または
「埼玉県電子申請・届出サービスによるオンラインでの電子納付」となります。
支払い方法、埼玉県証紙についての詳細は下記をご確認ください。
【窓口でのキャッシュレス納付について】
クレジットカード(Visa、Mastercard、JCB、American Express、Diners Club)、電子マネー等を利用できます。
【埼玉県電子申請・届出サービスによるオンラインでの電子納付について】
ペイジー(ネットバンクやATM)、クレジットカード(Visa、Mastercard、JCB、American Express、Diners Club)、コード決済を利用できます。
窓口申請後、電子納付をご希望の場合は、申請の受理時に案内用紙をお渡しします。
※電子納付方法の詳細については、「電子申請・届出サービスの電子納付について」をご参照ください。
※オンライン提出後、電子納付を行う場合の手続きは、下記の「7.申請等のオンラインによる提出について」をご参照ください。
【埼玉県証紙について】
埼玉県収入証紙は令和5年12月末で販売を終了し、令和6年3月末で使用ができなくなりました。
埼玉県収入証紙の廃止に伴い、収入証紙で納めて頂いていた手数料の収納方法としてキャッシュレス収納を令和5年10月から開始しています。
現在お持ちの埼玉県収入証紙で未使用のものについては、証紙を返還して証紙代金の還付を受けることができます。(令和10年12月末日まで)(参考:収入証紙の還付について)
それぞれの申請手数料については、下記のとおりです。
- 医薬品(PDF:66KB)
- 医薬部外品及び化粧品(PDF:83KB)
- GMP適合性調査(医薬品)(PDF:82KB)
- GMP適合性調査(医薬部外品)(PDF:80KB)
- 保管のみを行う登録業(PDF:52KB)
4.自主回収について
- (1)回収事由の発生から終了までの流れ
- (2)回収にあたっての留意事項
(1)回収事由の発生から終了までの流れ
- 情報の入手・分析
GQPの品質情報、GVPの安全管理情報を入手し、分析を行います。
適切な情報を迅速に入手し、検討できるよう、日頃から連携体制を整えておくことが重要になります。 - 回収の必要性の判断・回収の決定
回収の必要性の判断については、以下の通知を参考にしてください。
医薬品・医療機器等の回収について(PDF:1,254KB)(平成26年11月21日付け薬食発1121第10号厚生労働省医薬食品局長通知)
「医薬品・医療機器等の回収について」の一部改正について(PDF:1,114KB)(平成30年2月8日付け薬生発0208第1号厚生労働省医薬・生活衛生局長通知) - 回収作業着手(納入施設への情報提供、回収措置)
GQP手順書等の回収処理に関する手順等に基づいて、関係部門との連携のもと、回収作業を行ってください。また、実際の回収作業を開始するのに時間を要する場合、その間に保健衛生上の問題が拡大しないよう、あらかじめ納入施設に対して不良の発生を回避する方法や、不良が起こった時の対処方法などの情報を提供するようにしてください。 - 回収に係るインターネット原稿を埼玉県を通じて厚生労働省に提出
インターネット原稿は、インターネット掲載用資料作成用テンプレートで作成したファイルを提出してください。
インターネット掲載用資料作成用テンプレート(医薬品・医薬部外品・化粧品):PMDAのホームページ
インターネット掲載用資料作成時の注意点(医薬品・医薬部外品・化粧品):PMDAのホームページ
医薬品・医薬部外品・化粧品の回収:PMDAのホームページ - 回収着手報告書の提出 回収着手報告例(ワード:33KB)
- 回収状況報告書の提出 回収状況報告書例(ワード:27KB)
回収状況報告については、回収の進捗状況等を把握するために、以下の場合、報告を求めることがあります。
(1) 回収終了予定日が回収着手報告書に記載した日付を1か月以上延長する場合
(2) 回収に着手した時点では想定していなかった健康被害の発生の恐れを探知した場合
(3) 回収通知の第3の1.(3)4に規定する、回収の進捗状況について定期的な状況の報告を求める場合 - 回収終了報告書の提出 回収終了報告書例(ワード:32KB)
- 回収品の確認
回収終了報告書に記載されたとおりに回収できているか、薬事監視員が立ち入って確認します。
なお、回収終了報告書が提出され、回収作業を終了した事が確認出来次第、上記4記載のPMDAのホームページの備考欄に「回収終了」の文字が入ります。 - 回収品について廃棄等の処分
回収品の廃棄が生じた場合は、廃棄完了報告書を提出してください。
回収品の廃棄棄完了報告書例(ワード:28KB)
(2)回収にあたっての留意事項
- 医薬品・医薬部外品・化粧品に関する回収事由が発生した際は、速やかに下記担当まで御連絡ください。
⇒医薬品化粧品生産指導担当(048-830-3627)
また、回収することになりそうな事案が発見された場合や、回収の意志決定前の御相談もお受けしています。
なお、回収対象品目を輸出している場合は、この時点でご報告ください。 - 上記3~5の作業は、ほぼ同時に行うことになります。迅速な対応ができるよう、体制整備をお願いします。
- 副作用や不具合(あるいはその可能性)の発生による回収の場合は、医薬品医療機器等法第68条の10に基づく厚生労働大臣(独立行政法人医薬品医療機器総合機構安全部)への報告についても、確実に行ってください。
5.医薬品等の表示・広告の相談を希望される方へ
医薬品医療機器等法違反を未然に防止するため、埼玉県内の製造販売業者の方からの医薬品・医薬部外品・化粧品の表示・広告等に関する相談をお受けしています。
相談を希望される場合は、次の事項に留意されますようお願いします。
また、E-mailのみによる相談は、お受けしませんので御了承ください。
医薬品医療機器等法及び関連通知の確認
医薬品医療機器等法に関する表示については、医薬品医療機器等法に規定されているほか、医薬品等広告適正基準(平成29年9月29日付け薬生発第0929号第4号(PDF:483KB))等により規制されています。
これらの法条文や通知を確認いただき、疑問点を明確にしたうえ、御相談ください。
表示・広告原案の作成
御相談いただく際は、あらかじめ原案を作成し、事前にファックス等による原案を送付していただきますようお願いします。
6.緊急情報提供及び収集体制の整備について
埼玉県内で製造販売業、製造業の許可を取得している事業者の方の緊急時の連絡先等を確保するため、メールアドレス等の連絡先の登録をお願いします。
こちらの「緊急情報提供及び収集体制の整備について」をご覧ください。
7.申請等のオンラインによる提出について
オンライン提出を行うためには、申請電子データシステム(ゲートウェイシステム)へのユーザー登録や電子証明書の取得が必要になります。この申請については、厚生労働省FD申請サイト「オンライン提出関連」に掲載されている通知・マニュアル・動画等をご確認ください。
厚生労働省FD申請サイト「オンライン提出関連」(別ウィンドウで開きます)
オンライン提出については、以下の注意事項等にご留意の上、提出をお願いします。
注意事項
-
「医薬品医療機器等法対応医薬品等電子申請ソフト」(FD申請ソフト)を使用していない申請等については、オンラインによる提出はできません。
-
オンライン提出における受付日は、申請電子データシステム(ゲートウェイシステム)により提出されたデータに不備がない場合に限り「到達日」が受付日となります。ただし、休日等に提出され、到達した場合は、翌開庁日が受付日となります。なお、受付までの処理時間は、届出数の状況に左右されるため、複数日を要することがあります。
-
手数料が定められている申請の場合、申請の受理後に手数料の納付が必要となります。埼玉県では電子申請・届出サービス(下図参照)による電子納付(支払い方法はペイジーまたはクレジットカード)を導入しています。電子納付の申込URLについては、申請の受理後、ゲートウェイシステムより送付されるメールに記載されていますのでご確認ください。
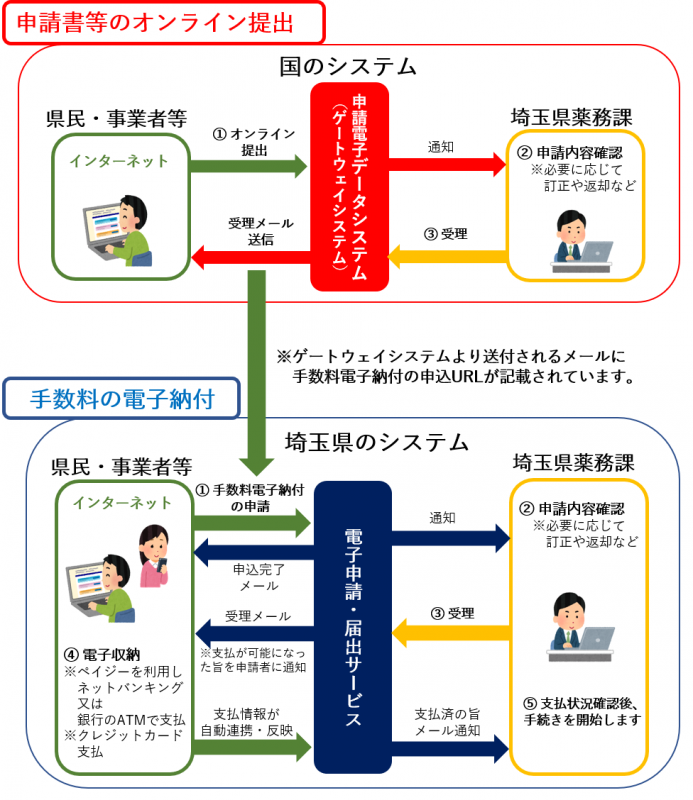
-
到達日以降の開庁日における確認において、次のような場合は、当該届出等をすべき手続上の義務が履行されたことにはなりませんので、ご注意ください。
当該届書等の記載事項に不備がある。
届書等に必要な書類が添付されていない。
その他の法令に定められた届出等の形式上の要件に適合していない。
-
手続上は申請・届出者の義務が履行された後においても、当該申請・届書の記載事項等が、医薬品医療機器等法その他薬事に関する法令、通知等の内容と適合していない場合は、申請・届出事項の変更を求めることがあります。
申請等のオンラインによる提出における資料の添付方法
-
申請・届書等に添付すべき書類その他の書類は、紙資料で提出するものを除き、原則としてPDFファイル(電子的に作成したものをPDFにする。若しくは、書類原本をスキャンしてPDFに変換する。)として提出してください。
-
申請書等に写しを添付し、窓口で原本と照合していた書類(薬剤師免許証等)については、申請者(法人によっては代表者)が、当該証書等の写しについて以下の(1)から(3)までに定める事項を記載して原本証明を行い、当該原本証明がなされた写しの電子ファイルを提出してください。
(1)当該写しが原本と相違ない旨
(2)原本証明を行う年月日
(3)申請者等の氏名(法人にあっては名称及び代表者の氏名)
新規許可申請等の実地調査を伴う申請等については、調査当日に現地で原本確認を行います。現地での確認が出来なかった場合、後日窓口まで原本を持参していただくことがありますのでご注意ください。
-
紙資料で添付書類を提出する際は、ゲートウェイシステムにより付与された番号及び当該書類の一覧を明記した書類(様式:書面で提出する書類等送付状(エクセル:12KB))の提出をお願いします。なおこの場合、その両方が到達した日が到達日となります。
-
更新申請、証書(許可証等)の書換え交付申請又は汚損による証書の再交付申請の際は、申請予定日の1営業日前に当課に到達するよう証書の原本を送付してください。
証書等の返信用封筒について
-
手続終了後に証書等が書面で発行される手続、取下げを行った際に書面が返送される場合、その他当課から申請者等に書面が送付される手続においては、当課に対し封筒(レターパック等の追跡可能なものが望ましい)を提出してください。
-
提出する封筒には、所要額の切手等を貼付(適合性調査結果通知書の送付時を除く)し、申請者等の住所、法人の場合は法人名及び部署名、担当者名を記載してください。なお、封筒の提出にあたっては、上記の書類等送付状を同封の上、申請予定日等の1営業日前に当課に到着するよう送付してください。
オンライン提出により申請等が行われたことを証する書類について
提出された申請等について埼玉県による受付が行われた場合、受付票が発行されますので、ゲートウェイシステムから当該受付票の取得をお願いします。
お問い合わせ
より良いウェブサイトにするためにみなさまのご意見をお聞かせください